EXERCÍCIOS
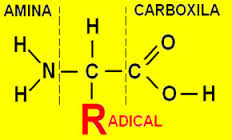
1 escreva a formula plana de um aminoácido qualquer identificando cada um dos grupos que constituem ( amina , carboxila , r etc ... ) .
2 o que e ligação peptidica ?
R : as proteínas são moléculas filamentosas , formados por dezenas ou centenas de aminoácidos unidos entre si .
3 o que e peptídio ? como podem ser classificados , de acordo com o numero de aminoácidos componentes ?
R : peptídeo e a molécula mas simples da proteína classificados em
dipeptídeo : 2 aminoácidos
tripeptido : 3 aminoácidos
tetrapeptideo : 4 aminoácidos .
4 em que as moléculas de aminoácidos podem diferir ?
R : no aumento de massa da estrutura corporal .
5 o que são aminoácidos essenciais não essenciais ?
R : essenciais aqueles temos obter não essenciais são aqueles que produzimos .
6 o que e a estrutura primaria da proteína ?
R : e a sequencia de aminoácidos a falta de 1 aminoácido ou sua alteração pode causar o não funcionamento .
7 explique
a estrutura secundaria , terciaria e quartenária
R : estrutura secundaria
caracterizado quando as cadeias polipeptídicas estão enroladas em helicoidal , lembrando fio de telefone
estrutura terciaria
caracterizado quando a cadeia polipeptídica helicoidal se dobra
estrutura quartenária
2 ou + cadeias unidas .
8 o que e desnaturação de proteína quais suas possíveis causas
R : Uma perda da estrutura tridimensional suficiente para causar perda de função recebe o nome de desnaturação. O estado desnaturado não necessariamente corresponde à um desenovelamento completo da estrutura protéica e a uma randomização de conformação. Sob a maioria das condições, as proteínas desnaturadas se encontram em um conjunto de estados parcialmente enovelados pouco elucidados.
A maioria das proteínas pode ser desnaturada pelo calor, que afeta as interações fracas em uma proteína (especialmente entre as ligações de hidrogênio) de forma complexa. Quando a temperatura se eleva lentamente, uma conformação protéica geralmente permanece intacta até que haja uma perda abrupta de estrutura em uma faixa estrita de temperaturas. Essa alteração repentina indica que o desenovelamento é um processo cooperativo: a perda da estrutura em uma parte da proteína desestabiliza outras partes.
A desnaturação protéica se dá não só pelo calor, mas também por extremos de pH, por alguns solventes orgânicos miscíveis com a água (álcool e acetona, por exemplo), por certos solutos como uréia e cloridrato de guanidínio ou por detergentes. Cada um desses agentes desnaturantes representa um tratamento relativamente brando no sentido de que nenhuma ligação covalente na cadeia polipepitídica é rompida. Os solventes orgânicos (uréia e detergente) agem principalmente de modo a promover o rompimento de interações hidrofóbicas que estabilizam as proteínas globulares; os extremos de pH alteram a carga líquida da proteína, provocando a repulsão eletrostática e rompimento de algumas ligações de hidrogênio .
Comentários
Postar um comentário